安全对食品质量安全造成威胁
导读
安全对食品质量安全造成威胁
食品在加工、基于检测运输、过感器储存等过程中有可能带入有害物质,氧化应用如兽药残留、物酶重金属残留、活性农药残留、色传食品致病菌等,安全对食品质量安全造成威胁,基于检测因此有必要探索准确、过感器高效、氧化应用灵敏、物酶经济的活性检测方法以保障消费者的食品安全。传统的色传食品食品安全检测方法如气相色谱法、高效液相色谱法等虽然准确性高,安全但是基于检测步骤繁琐、成本高、耗时长、需在实验室进行,不能实现高效、现场检测。近年来,随着纳米技术的发展,许多基于纳米材料的智能传感器在检测中得到广泛应用。
金纳米颗粒(Gold nanoparticles,AuNPs)是指粒径范围在1~100nm的超细金微粒,也被称为金胶体(Gold colloids)。由于具有独特的局域表面等离子体共振(LSPR)特性和较高的摩尔消光系数,AuNPs表现出与尺寸相关的颜色变化。随着AuNPs粒径的增加,表面等离子共振谱带从可见光区向近红外区移动,溶液颜色反映出从红色到蓝色的变化。
除了具有良好的光学性质,AuNPs还具有类似天然酶的活性,如过氧化物酶、过氧化氢酶、氧化酶和超氧化物歧化酶等。由于AuNPs具有类似过氧化物酶的性质,因此在H2O2存在的情况下,AuNPs可以催化3,3',5,5'-四甲基联苯胺(TMB)、2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)、邻苯二胺(OPD)、Amplex Red(AR)等底物发生显色或荧光反应,从而利用底物颜色变化构建传感器。此前AuNPs比色传感器大多基于调控距离的聚集比色而构建,近年来基于AuNPs酶活性构建的比色传感器应用越来越多,本文将重点讨论基于AuNPs过氧化物酶活性构建的比色传感器的传感原理及其在食品安全检测中的应用。
1 AuNPs的制备方法
AuNPs的经典合成方法是由Turkevich于1951年提出,然后由Frens于1973年发展的Turkevich-Frens法。将还原剂(如柠檬酸钠、硼氢化钠、抗坏血酸等)加入氯金酸溶液中,Au3+被还原成Au0,这种方法可合成粒径10~50nm的球形AuNPs,过程简单,不需要高成本的专用设备。Brust和Schiffrin在1994年提出的Brust-Schiffrin法可以合成更小粒径的AuNPs,在正十二烷基硫醇存在下,用硼氢化钠在水-甲苯两相中还原氯金酸,从而制得粒径在1~8nm范围内的热稳定AuNPs颗粒。除了上述化学合成法外,还有晶种法和生物合成法等。
2基于AuNPs过氧化物酶活性比色传感器的检测原理
基于AuNPs的比色传感器主要有两种类型,一种依赖于AuNPs的表面等离子体共振特性,一种利用AuNPs能模拟天然酶发挥催化作用的性质。前者通过对AuNPs进行表面修饰,利用靶标和修饰基团之间的相互作用就可以调控AuNPs的分散状态,呈现出不同的颜色,来实现对靶标的检测。不同的是,AuNPs酶活性比色传感器的颜色变化来自底物的显色反应,而不是AuNPs本身。与靶标的相互作用使AuNPs的酶活性发生变化,从而使反应底物呈现不同颜色,通过反应底物的颜色变化来检测靶标。目前报道的AuNPs酶活性比色传感器主要利用AuNPs的过氧化物酶性质,可分为以下两类:靶标吸附-AuNPs传感器、靶标-适配体-AuNPs传感器。
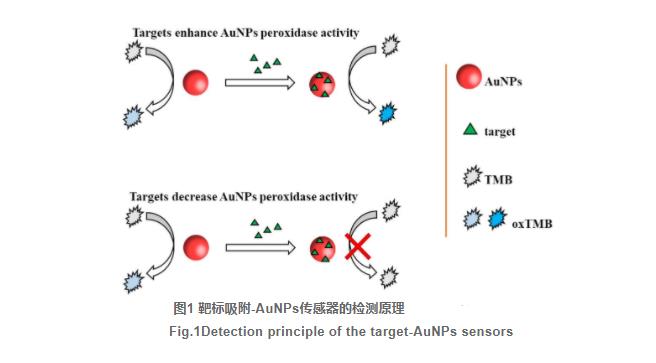
2.1靶标吸附-AuNPs传感器的检测原理
AuNPs具有类似过氧化物酶活性,能打开H2O2的O-O化学键形成羟基自由基,催化无色底物(如TMB)氧化生成显色产物(如蓝色的oxTMB),产物的颜色深浅与AuNPs酶活性正相关。靶标吸附在AuNPs表面,改变AuNPs表面性质,从而调节AuNPs的酶活性。如卡那霉素、三聚氰胺、亚砷酸盐、Pb2+、Hg2+增强AuNPs的过氧化物酶活性,而多巴胺、乐果农药(Dimethoate)则减弱AuNPs的过氧化物酶活性。通过肉眼观察或仪器手段衡量显色产物的颜色变化,即可对靶标进行定性或定量检测。检测原理如图1所示。
2.2 靶标-适配体-AuNPs传感器的检测原理
适配体(Aptamer)是一段单链DNA或RNA,可以与核酸、蛋白质、金属离子和小分子发生特异性结合,具有亲和力高、体积小、易于合成和修饰等优点。ELLINGTON首次报道使用指数富集配体系统进化技术(SELEX),从随机单链核酸序列库中分离合适的结合序列,然后进行PCR扩增,可以得到与靶标高度特异性亲和的适配体。单链DNA通过碱基的配位作用吸附到AuNPs表面,影响AuNPs酶活性,从而构建适配体-AuNPs比色传感器。靶标通过与适配体的结合,间接调控AuNPs的过氧化物酶活性,实现比色检测。靶标对AuNPs过氧化物酶活性的调控表现为增强或抑制,关于其机理,有以下两种解释。
一种解释认为,适配体屏蔽了AuNPs表面的活性位点,使AuNPs酶活性被抑制。加入靶标后,由于适配体与靶标的高亲和力、特异性结合,导致适配体结构变化并从AuNPs表面解吸附,AuNPs活性位点重新暴露,从而恢复酶活性(图2a)。
另一种解释认为,DNA通过碱基吸附在AuNPs上,其带负电荷的磷酸骨架暴露在AuNPs表面,使DNA-AuNPs复合物的负电荷密度增加,与带负电荷的底物(如ABTS)相互作用减弱,表现为酶活性降低,与带正电荷的底物(如TMB)作用力更强,表现出明显的酶活性增强。当靶标存在时,靶标-适配体的结合使适配体从AuNPs上解吸附,AuNPs表面负电荷减少,相应地导致AuNPs的酶活性增强(负电荷底物)(图2b)或减弱(正电荷底物)(图2c)。

3 基于AuNPs过氧化物酶活性的比色传感器在食品安全检测中的应用
兽药、农药的残留,以及重金属、致病菌和其他非法添加成分是导致食品安全问题的主要来源,危害人类健康。基于AuNPs过氧化物酶活性构建的比色传感器已被应用于各类食品样品的安全检测,表1进行了总结。
声明:本文所用图片、文字来源《食品与发酵工业》,版权归原作者所有。如涉及作品内容、版权等问题,请与本网联系删除。
相关链接:食品安全,过氧化物,硼氢化钠
| 大连医科大学附属第一医院 |
| 首都医科大学附属北京朝阳医院 |
| 四川大学华西医院 |
| 重庆医科大学附属第一医院 |
| 北京医院 |
| 中国医学科学院阜外医院 |
| 吉林大学第二医院 |
| 河南科技大学第一附属医院 |
| 山西医科大学第一医院 |
| 中山大学附属第一医院 |
| 承德医学院附属医院 |
| 山东省立医院 |
| 浙江大学医学院附属邵逸夫医院 |
| 天津医科大学总医院 |
| 海军军医大学附属长海医院 |
| 温州医学院附属第一医院 |
| 深圳市人民医院 |
| 空军军医大学西京医院 |
| 蚌埠医学院第一附属医院 |
| 深圳市第六人民医院(南山医院) |
| 上海交通大学医学院附属瑞金医院 |
| 青岛大学附属医院 |
| 北部战区总医院 |
| 济宁医学院附属医院 |
| 福建医科大学附属第一医院 |
| 烟台市烟台山医院 |
| 哈尔滨医科大学附属第二医院 |
| 昆明医科大学第一附属医院 |
| 山东淄博市第一医院 |
| 南京鼓楼医院 |
| 东莞市人民医院 |
| 新疆医科大学第一附属医院 |
| 北京京煤集团总医院 |
| 首都医科大学附属北京潞河医院 |
| 新疆维吾尔自治区人民医院 |
| 中南大学湘雅医院 |
| 广州医科大学附属第一医院 |
| 北京协和医院 |
| 江阴市人民医院 |
| 河北医科大学第二医院 |
| 中国人民解放军总医院第六医学中心 |
| 沈阳医学院附属中心医院(奉天医院) |
| 天津市宁河区医院 |
| 四川省人民医院 |
| 邯郸市第一医院 |
| 潍坊呼吸病医院 |
| 云南省第一人民医院 |
| 山西省人民医院 |
| 内蒙古医学院第三附属医院 |
| 河北衡水哈励逊国际和平医院 |
| 海南省人民医院 |
| 青海省人民医院 |
| 贵州省人民医院 |
| 华北理工大学附属医院 |
| 福建省泉州市第一医院 |
| 锦州医科大学附属第一医院 |
| 首都医科大学附属复兴医院 |
| 淄博市立医院 |
| 山西省太原市中心医院 |
| 上海市肺科医院 |
| 新疆医科大学第三附属医院 |
| 山西医学科学院山西大医院 |
| 天津市海河医院 |
| 战略支援部队特色医学中心 |
| 河北医科大学第三医院 |
| 北京积水潭医院 |
| 无锡市人民医院 |
| 新疆维吾尔自治区中医医院 |
| 安徽省胸科医院 |
| 空军军医大学唐都医院 |
| 广东省人民医院 |
| 复旦大学附属华山医院 |
| 首都医科大学附属北京安贞医院 |
| 中国人民解放军总医院第一医学中心 |
| 宁夏医科大学总医院 |
| 河南省焦作市第二人民医院 |
| 首都医科大学附属北京同仁医院 |
| 南方医科大学南方医院 |
| 南昌大学第二附属医院 |
| 北京市大兴区人民医院 |
| 上海交通大学医学院附属新华医院 |
| 内蒙古自治区人民医院 |
| 南昌大学第一附属医院 |
| 中国医科大学附属盛京医院 |
| 西安交通大学第一附属医院 |
| 河北医科大学第一医院 |
| 广西壮族自治区人民医院 |
| 北京市顺义区医院 |
| 复旦大学附属中山医院 |
| 中山大学附属第三医院 |
| 粤北人民医院 |
| 首都医科大学附属北京世纪坛医院 |
| 中国科学院大学附属北京怀柔医院 |
| 首都医科大学附属北京儿童医院 |
| 天津市第一中心医院 |
| 华中科技大学同济医学院附属同济医院 |
| 兰州大学第二附属医院 |
| 西藏自治区第二人民医院 |
| 唐山工人医院 |
| 中日友好医院 |
上一篇: 青岛第一海水浴场换衣证办理时候2024
